Volume 2, Nomor 2,
Tahun 2013, Halaman
Online di:
http://ejournal-s1.undip.ac.id/index.php/jmr
Pengaruh Perbedaan Periode Aerasi Karbondioksida terhadap Laju Pertumbuhan
dan Kadar Total Lipid pada Kultur Nannochloropsis
oculata
Puji Norbawa*), Ervia Yudiati dan Widianingsih
Program Studi Ilmu Kelautan, Fakultas
Perikanan dan Ilmu Kelautan, Universitas Diponegoro
Kampus Tembalang, Semarang 50275
Telp/Fax. 024-7474698
email: annurbawa@gmail.com
Abstrak
N. oculata biasa digunakan sebagai pakan alami dalam bidang budidaya. Selain digunakan
sebagai pakan, N. oculata berpotensi
sebagai sumber energi alternatif karena mempunyai kandungan lipid yang besar.
Mikroalga dapat memanfaatkan CO2 pada proses fotosintesis sehingga
bisa digunakan sebagai degradator karbondioksida. Pemberian aerasi karbondioksida diharapkan
dapat meningkatkan laju pertumbuhan N.
oculata serta produksi total lipid yang dihasilkan. Penelitian ini
bertujuan untuk mengetahui pengaruh perbedaan periode aerasi karbondioksida pada kultur N. oculata terhadap laju pertumbuhan dan
produksi total lipid yang dihasilkan. Hasil penelitian menunjukkan bahwa
perbedaan periode aerasi karbondioksida berpengaruh dengan beda nyata (P <
0,05) terhadap laju pertumbuhan rata – rata dan produksi total lipid. Perlakuan aerasi CO2 selama 3
menit mempunyai laju pertumbuhan rata - rata paling tinggi yaitu 0,574
doubling/hari. Sementara laju
pertumbuhan rata – rata pada perlakuan aerasi selama 4 menit hampir sama dengan
kontrol yang masing – masing mempunyai laju pertumbuhan 0,484 doubling/hari dan 0,462 doubling/hari. Presentase produksi kadar
total lipid terbesar dihasilkan pada perlakuan dengan aerasi karbondioksida
selama 4 menit sebesar 80,58%. Kemudian dilanjutkan dengan perlakuan aerasi
karbondioksida selama 1 menit, 2 menit dan kontrol masing – masing menghasilkan
lipid sebesar 65,98 %-dw; 65,77%-dw dan 64,98%-dw. Sedangkan pemberian aerasi
karbondioksida selama 3 menit mempunyai nilai terkecil yaitu sebesar 39,72%-dw.
Berdasarkan hasil penelitian dapat disimpulkan bahwa pemberian aerasi
karbondioksida selama 3 menit dapat meningkatkan laju pertumbuhan rata- rata N. oculata. Namun peningkatan laju
pertumbuhan tersebut tidak disertai dengan peningkatan produksi total lipid.
Kata kunci: Nannochloropsis
oculata, karbondioksida, laju pertumbuhan, total lipid
Abstract
N. oculata is commonly used as a natural food in larviculture. Due
to the fact on its highly lipid content, N.
oculata is recently becoming one of a good candidate for
a source of alternative energy. Microalgae utilizes CO2 during photosynthesis. This fact will
lead and used this microalgae as a carbondioxide degradator. Providing of carbon dioxide aeration is expected to increase the rate of growth of N. oculata as well as total lipid
production. This research aimed to determine the effect of different
periods on carbondioxide aeration
on the growth rate and total lipid production in N. oculata culture. The results showed that different time on carbondioxide aeration was significantly
different (P < 0.05) on the average growth rate as well as total lipid production. Carbondioxide aeration treatment for 3 minutes
have the highest average growth rate which is 0,574 doubling/ day. While the average growth rate at
treatment aeration for 4 minutes almost equal to the control i.e. 0,484 doubling/ day and 0,462 doubling/ day. The highest percentage of
total lipid production has reached
in 4 minutes carbondioxide aeration treatment (80.58%-dw). Furthermore,
the lipid production on 1 minute, 2 minutes aeration time and control were 65.98%-dw, 65.77%-dw and 64.98%-dw,
respectively. The treatment with carbondioxide aeration for 3 min was the lowest
(39.72%-dw). Based on these
results it can be concluded that carbondioxide aeration for 3 minutes increased the growth rate of N. oculata.
However, the increment on growth rate were not accompanied with the increment on total lipid
production.
Keywords:Nannochloropsis oculata, carbondioxide, growth rate,
total lipid
*) Penulis penanggung jawab
Pendahuluan
Mikroalga merupakan
mikroorganisme prokariotik atau eukariotik yang dapat berfotosintesis dan dapat
tumbuh cepat pada kondisi yang sulit (Mata et al., 2010). Semua jenis
mikroalga memiliki komposisi kimia sel yang terdiri dari protein, asam nukleat,
karbohidrat dan lipid . Mikroalga juga mengandung bahan-bahan organik seperti
polisakarida, hormon, vitamin, mineral dan juga senyawa metabolit sekunder
(Richmond, 2003). Mikroalga sudah lama dikenal sebagai sumber protein dalam
budidaya larva udang ataupun ikan (Ikhsan et
al, 2006) dan sebagai suplemen makanan bagi manusia (Andersen, 1995).
Pemanfaatan mikroalga dalam bidang farmakologi meliputi antibakteri,
antioksidan, antijamur, dan antivirus (Chang et al., 1993).
Selain hal tersebut,
mikroalga juga berpotensi sebagai sumber energi terbarukan (Chisti, 2007).
Namun kenyataannya, hingga saat ini pemanfaatan mikroalga terutama dalam
kaitannya sebagai sumber energi masih belum maksimal. Karbondioksida merupakan
faktor pembatas dalam kultur mikroalga. Penambahan karbondioksida akan
mencukupi kebutuhan karbon mikroalga yang selanjutnya akan disintesis menjadi
energi.
Energi yang dihasilkan pada proses fotosintesis mikroalga dapat digunakan
sebagai pertumbuhan, cadangan makanan atau untuk mempertahankan diri saat
terjadi tekanan pada lingkungan (Khoo et
al., 2011).
Proses
biosintesis lipid pada mikroalga membutuhkan energi yang besar, diawali dengan
proses pembentukan karbohidrat kemudian dilanjutkan dengan akumulasi lipid
(Ahmad et al., 2011). Chisti (2007)
juga mengatakan bahwa aerasi karbondioksida
akan memacu proses fotosintesis pada reaksi Calvin. Laju fotosintesis pada
mikroalga yang diberi aerasi dengan CO2 akan memacu sintesis karbohidrat. Karbohidrat
yang berlebihan dalam sel mikroalga akan dikonversi dalam bentuk total lipid.
Materi
dan Metode
a.
Kultur Mikroalga
Stok
N. oculata
yang diperoleh dari Balai Besar
Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Kultur dilakukan dengan cara menambahkan 2,5 L
stok murni (1/3 bagian) ke dalam media air laut dengan salinitas 30 ppt sebanyak 5 L
(2/3 bagian). Selanjutnya ditambahkan pupuk Walne
(NH4NO3 100 g; NaH2PO4 20 g; H3BO3 33,6 g; NaEDTA 45 g; FeCl2 1,3 g; MnCl2 0,36 g; Vitamin B12 0,001 g) yang diperoleh dari BBPBAP Jepara sebanyak 7,5 ml (dosis 1ml/L) Proses menghasilkan stock murni 7,5 liter. Selanjutnya dilakukan penanaman pada erlenmeyer dengan
volume 500 ml. Selanjutnya kultur N.
oculata dinkubasi dalam suhu 17-20oC dan pencahayaan (2750 lux
selama 24 jam/hari).
b.
Aerasi Karbondioksida
Aerasi karbondioksida
dilakukan setiap 24 jam hingga waktu panen. Setiap perlakukan menggunakan 3
ulangan, diaerasi dengan waktu yang berbeda yaitu 1, 2, 3 dan 4 menit serta
tanpa aerasi CO2 sebagai kontrol. Setelah dilakukan aerasi
karbondioksida kemudian dilakukan penghitungan CO2 terlarut dengan
metode titrasi. Volume sampel 20 mL yang telah ditambahkan 2 tetes indikator PP
dititrasi dengan menggunakan larutan Na2CO3 0,0454 N. Selanjutnya Konsentrasi karbondioksida (CO2)
terlarut dihitung dengan menggunakan rumus APHA (1978):
c. Penghitungan Kepadatan
dan Panen
Penghitungan kepadatan
dilakukan dengan menggunakan haemacytometer. Panen dilakukan pada fase stasioner awal dengan cara sentrifugasi.
Kemudian dilanjutkan dengan peyaringan sebanyak 100 mL kultur N. oculata
menggunakan kertas Whatman GF/F dengan bantuan vacum pump dan miliphore. Laju pertumbuhan relatif dihitung
dengan rumus (Wood et al., 2005):
d. Analisa lipid
mikroalga N. oculata
Ekstraksi lipid
yang akan dilakukan merupakan
modifikasi dari metode Bligh and Dyer
(1965). Biomassa kering N.
oculata dimaserasi menggunakan metanol sebanyak 60 ml. Maserasi dilakukan pada suhu 400
celcius selama 2 jam. Perlakuan secara mekanik ditambahkan
dengan melakukan
stirring selama 10 menit menggunakan magnetik strirer. Kemudian
ditambahkan N-hexan
sebanyak 60 ml. Selanjutnya dilakukan pemisahan fraksi metanol dan n- heksan
dengan menggunakan corong pisah. Setelah di dapatkan fraksi n – heksan
dilakukan proses evaporasi pelarut menggunanakan oven dengan suhu 110oC
untuk mendapatkan total lipid. Kemudian dilakukan proses penimbangan lipid.
Hasil
dan Pembahasan
a.
Kepadatan N. oculata
Penambahan
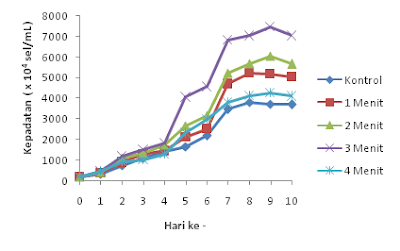
aerasi CO2 selama 3 menit menunjukkan pertumbuhan logaritmik paling
tinggi. Kepadatan sel tertinggi terjadi pada hari ke- 9 yaitu mencapai 7.483 x
104 sel/ml. Sementara pada
kontrol, 1 menit, dan 2 menit kepadatan sel masing – masing yaitu 3.720 x 104 sel/ml, 5.172 x 104 sel/ml, 6.040 x 104 sel/ml. Penambahan aerasi CO2
tidak selalu direspon positif dengan penambahan pertumbuhan logaritmik oleh N. oculata. Hal ini ditunjukkan oleh
hasil pertumbuhan logaritmik pemberian
aerasi CO2 selama 4 menit yang justru mengalami penurunan. Kepadatan
sel pada perlakuan 4 menit yaitu 4.284 x 104 sel/ml. Chiu et al., (2008) menjelaskan
bahwa pemberian aerasi karbondioksida yang terlalu banyak dapat menghambat pertumbuhan
N. oculata karena kondisi pH yang
terlalu rendah.
Gambar
1. Grafik pertumbuhan harian N. oculata pada perlakuan perbedaan
periode aerasi karbondioksida
Karbondioksida yang
diberikan berfungsi sebagai bahan utama dalam proses fotosintesis mikroalga
sehingga dapat meningkatkan laju proses fotosintesis yang mengakibatkan
meningkatnya kelimpahan sel N. oculata.
Hal tersebut sesuai dengan hasil penelitian yang dilakukan oleh Chiu et al.,
(2008) pemberian gas karbondioksida pada kultivasi N. oculata dengan konsentrasi 2%
mampu meningkatkan jumlah kelimpahan sel N. oculata hingga 50 % dibandingkan dengan Kontrol. Namun
penambahan gas karbondioksida sebanyak 5% justru menghambat pertumbuhan.
Beberapa penelitian
lain juga menunjukkan bahwa pemberian aerasi karbondioksida dapat meningkatkan
kepadatan puncak, tetapi setelah melebihi batas maksimal justru menghambat
pertumbuhan N. oculata. Penghambatan
pertumbuhan N. oculata terjadi pada pemberian aerasi dengan
konsentrasi gas karbondioksida lebih dari 5% (Silva dan Pirt, 1984; Sung et al., 1999; Chang dan Yang, 2003; de
Morais dan Costa, 2007a,b).
Penambahan
karbondioksida pada kultur N. oculata
akan mencukupi kebutuhan karbon yang digunakan untuk proses fotosintesis. Proses fotosintesis pada N. oculata akan menghasilkan energi. Energi tersebut dapat berupa
karbohidrat, lipid dan protein. Energi yang dihasilkan pada proses fotosintesis
mikroalga dapat digunakan sebagai pertumbuhan, cadangan makanan atau untuk
mempertahankan diri saat terjadi tekanan pada lingkungan (Khoo et al., 2022). Pada perlakuan pemberian
aerasi CO2 selama 4 menit dimungkinkan energi yang dihasilkan dari
proses fotosintesis tidak digunakan untuk pembelahan sel melainkan dikonversi
atau disimpan dalam bentuk lain. Pada perlakuan 4 menit terjadi tekanan
lingkungan yang cukup ekstrim dimana pH pada kultur mencapai 5,2 serta
salinitas mencapai 35 ppt.
b.
Laju Pertumbuhan N. oculata
Laju
pertumbuhan rata - rata pada perlakuan Kontrol, 1 menit, 2 menit, 3 menit dan 4
menit masing – masing menunjukkan hasil 0,462; 0,515; 0,540; 0,574 dan 0,484
doubling/ hari.
Gambar 2. Laju pertumbuhan
rata - rata N. oculata selama kultur
denganperlakuan waktu aerasi karbondioksida yang berbeda
Tabel 9. Laju pertumbuhan
harian (doubling/hari) N.
oculata dengan perlakuan perbedaan periode aerasi karbondioksida
Pada penelitian ini
fase adaptasi terjadi secara singkat. Hal ini ditunjukkan dengan laju
pertumbuhan yang cukup tinggi sejak hari pertama. Laju pertumbuhan pada hari
pertama pada perlakuan Kontrol, 1 menit, 2 menit, 3 menit dan 4 menit yaitu
0,701; 0,904; 0,987; 1,083 dan 1,203 doubling/ hari. Kultur N. oculata dengan perlakuan pemberian
aerasi karbondioksida mempunyai fase adaptasi yang singkat. Fase adaptasi
menjadi fase yang penting karena pada
fase ini mikroalga menyesuaikan diri dengan lingkungan yang baru (Chiu et al., 2008). Boyd (1982) juga menjelaskan bahwa penambahan CO2
dalam kultur menyebabkan terjadinya penurunan pada pH air. Pada hari ke- 2
terjadi laju pertumbuhan tertinggi dibandingkan dengan laju pertumbuhan hari
lain. Laju pertumbuhan pada hari ke- 2 pada perlakuan kontrol, 1 menit, 2
menit, 3 menit dan 4 menit yaitu 1,113; 1,219; 1,425; 1,435 dan 0,940 doubling/
hari. Pada hari ke- 2 laju pertumbuhan paling tinggi terjadi pada perlakuan 3
menit.
Pada perlakuan aerasi
CO2 selama 4 menit, pada hari pertama mengalami laju pertumbuhan
tertinggi dibanding dengan perlakuan lain justru pada hari ke- 2 mengalami
penurunan. Hal ini dimungkinkan karena pengaruh pemberian aerasi CO2
pada kultur N. oculta. Penambahan
karbondioksida dapat memenuhi kebutuhan karbon N. oculata yang digunakan sebagai bahan fotosintesis. Panggabean
(2011) menjelaskan bahwa kemampuan pemanfaatan karbondioksida pada mikroalga N. oculata dan Chlorella vulgaris tergolong tinggi dibandingkan dengan spesies
lain. Penambahan karbondioksida secara tepat pada N. oculata dapat menaikkan laju pertumbuhan. Chiu et al., (2008) juga menjelaskan bahwa penambahan karbondioksida
sebanyak 2% dapat meningkatkan laju pertumbuhan. Namun penambahan
karbondioksida lebih dari 5% justru dapat menghambat laju pertumbuhan.
Laju pertumbuhan yang
cukup tinggi pada awal kultur dimungkinkan pada fase eksponensial mikroalga
lebih banyak mensintesis protein yang digunakan untuk pembelahan sel. Bellou
dan Aggelis (2013) menjelaskan bahwa saat
kualitas air menunjang untuk pertumbuhan mikroalga serta masih tersedia
nitrogen dalam media, mikroalga akan mensintesis protein yang digunakan untuk
proses pembelahan sel. Namun saat nitrogen dalam media kultur sudah habis
mikroalga lebih banyak mengakumulasi hasil fotosintesis dalam bentuk lipid.
Widianingsih et al., (2011)
menjelaskan bahwa semakin kecil konsentrasi fosfat dan nitrat yang diberikan
pada kultur N. oculata maka total
lipid yang dihasilkan semakin besar. Jumlah fosfat dan nitrat yang besar dalam
media kultur menyebabkan N. oculata lebih banyak memproduksi
protein dan karbohidrat (Hu dan Gao, 2006). Chiu et al., (2008) juga menjelaskan produksi total lipid mikroalga
tertinggi terjadi pada fase stasioner. Hasil penelitian Widianingsih et al., (2011) juga menunjukkan bahwa
pada fase stasioner N. oculata memiliki kadar total lipid yang lebih
besar dibandingkan pada fase eksponensial. Besarnya kandungan lipid total pada
mikroalga N. oculata pada fase stasioner dibandingkan dengan fase
eksponensial juga telah ditunjukkan oleh hasil penelitian Pratoomyot et al.,
(2005) begitu pula pada spesies Tetraselmis suecica (Guzman et al.,
2010). Guzman et al., (2010) juga menambahkan bahwa pada fase stasioner
telah terjadi penurunan pembelahan sel dan sel mulai menyimpan produknya dalam
bentuk lipid . Semakin menurunnya jumlah nutrien pada fase stasioner
mengakibatkan terjadinya penurunan pembelahan sel pada mikroalga kelas
Eustigmatophyceae dan Bacillariophyceae secara bertahap dan mulai menyimpan
produknya dalam bentuk lipid (Pratoomyot et al., 2005).
c.
Kadar Total Lipid N. oculata
Peningkatan
lipid paling besar terjadi pada perlakuan pemberian aerasi CO2
selama 4 menit. Pada perlakuan ini kadar total lipid yang dihasilkan mikroalga Nannochloropsis oculata mencapai 81, 26%-dw.
Sementara pada kontrol, 1 menit, dan 2 menit mempunyai kadar total lipid yang
relatif sama yaitu 65,47%-dw, 65,53%-dw dan 65,32%-dw. Sedangkan pada perlakuan
pemberian aerasi karbondioksida selama 3 menit justru mengalami penurunan yang
signifikan, yaitu 39,86%-dw.
Gambar 3. Kadar
total lipid N. oculata (% berat
kering) pada perbedaan periode aerasi
yang berbeda
Kondisi peningkatan lipid
yang terjadi pada perlakuan pemberian aearasi CO2 selama 4 menit
berbanding terbalik dengan kepadatan puncak serta laju pertumbuhan. Kondisi ini
juga terjadi pada perlakuan aerasi CO2 selama 3 menit. Pada
perlakuan tersebut produksi total lipid yang dihasilkan N. oculata menunjukkan terjadinya penurunan. Namun kepadatan puncak
serta laju pertumbuhan rata - rata justru mengalami peningkatan dan mempunyai nilai
tertinggi dibanding dengan perlakuan lain. Penambahan karbondioksida akan
memenuhi kebutuhan karbon pada mikroalga yang selanjutnya digunakan sebagai
bahan fotosintesis.
Proses fotosintesis akan menghasilkan energi. Energi tersebut dapat berupa
karbohidrat, lipid dan protein. Energi yang dihasilkan pada proses fotosintesis
mikroalga dapat digunakan sebagai pertumbuhan, cadangan makanan atau untuk mempertahankan
diri saat terjadi tekanan pada lingkungan (Khoo et al., 2011). Pada perlakuan aerasi karbondioksida selama 3 menit
dimungkinkan energi yang dihasilkan dari proses fotosintesis digunakan sebagai
pertumbuhan N. oculata. Hal ini juga
dikuatkan oleh Ehrenfeld dan Cousin (1982) yang menyatakan bahwa dalam kondisi
optimum mikroalga lebih banyak melakukan sintesisa protein yang digunakan untuk
sintesis DNA yang selanjutnya digunakan sebagai proses pembelahan sel.
Sedangkan pada perlakuan aerasi selama 4 menit kemungkinan besar energi yang
dihasilkan digunakan sebagai upaya mempertahankan diri saat terjadi tekanan
lingkungan. Schenk et al., (2008)
juga menyatakan bahwa mikroalga di alam mengakumulasi lipid saat terjadi
tekanan pada lingkungan. Dalam kondisi tidak optimal tersebut mikroalga tetap
melakukan proses fotosintesis dengan bantuan CO2 dan mengakumulasi
energi dalam bentuk karbohidrat dan lipid. Penggunaan karbondioksida pada
kultur mikroalga juga dilakukan oleh Olaizola et al., (2004) dijelaskan
bahwa bahwa mikroalga dapat menyerap karbondioksida pada kisaran pH 4,5 – 10,5
dengan konsentrasi karbondioksida yang berbeda. Selanjutnya Boyd (1982) juga
mengatakan pada pH 4,5- 6,5 reaksi yang terbentuk antara karbondioksida dan air
akan menghasilkan asam karbonat. Sedangkan pada pH 6,5- 10,5 reaksi
karbondioksida dan air akan menghasilkan bikarbonat. Pembentukan senyawa yang
berbeda inilah yang dimungkinkan berpengaruh terhadap penyerapan karbondioksida
pada N. oculata. Asam karbonat dan
bikarbonat selanjutnya akan digunakan sebagai sumber karbon anorganik dalam
proses fotosintesis mikroalga. Pada proses fotosintesis mikroalga, sumber karbon
anorganik yang berasal dari senyawa asam
karbonat dan bikarbonat dapat dikonversi menjadi energi. Namun jumlah asam
karbonat yang berlebihan menyebabkan air bersifat asam. Kondisi pH selama
kultur mempengaruhi penyerapan karbondioksida pada N. oculata karena pada kondisi tidak optimal mikroalga lebih banyak
menggunakan energi sebagai upaya mempertahankan diri dan mengakumulasinya dalam
bentuk lipid. Mikroalga dapat memanfaatkan karbon sebagai proses fotosintesis
dalam bentuk asam karbonat, bikarbonat, karbonat atau CO2 bebas.
Berbeda dengan tumbuhan tingkat tinggi yang hanya bisa memanfaatkan CO2
bebas yang terdapat di atmosfir melalui stomata dan lenti sel (Khoo et al.,
2011).
Chisti (2007) juga
mengatakan bahwa aerasi karbondioksida
akan memacu proses fotosintesis pada reaksi Calvin. Laju fotosintesis pada
mikroalga yang diberi aerasi dengan karbondioksida
akan memacu
sintesis karbohidrat. Karbohidrat yang berlebihan dalam sel mikroalga akan
dikonversi dalam bentuk total lipid.
Bellou dan Aggelis (2013) menyatakan
bahwa sintesa lipid diawali dengan sintesa karbohidrat. Dalam proses
fotosintesis CO2 dikonversi menjadi gliceryde – 3 – phosphate (G3P)
yang digunakan sebagai prekusor dalam pembentukan karhohidrat dan lipid.
Selanjutnya Gliceryde- 3- phosphate diubah menjadi piruvat. Piruvat kemudian
dikonversi menjadi asetil- koA dengan reaksi mengguakan enzim pyruvate
dehydrogenase complex (PDC). Asetil- koA merupakan prekusor untuk sintesis asam
lemak. Reaksi pembentukan asam lemak ini terjadi dalam plastida. Selanjutnya
asam lemak yang terbentuk di plastida akan dibawa menuju retikulum endoplasma.
Retikulum endoplasma akan mengubah asam lemak
menjadi lipid struktural atau lipid non struktural. Lipid struktural
adalah lipid yang digunakan dalam pembentukan komponen sel. Sedangkan lipid non
struktural adalah lipid yang digunakan sebagai bentuk cadangan energi.
Kesimpulan
aerasi
karbondioksida selama 3 menit optimal untuk meningkatkan kepadatan puncak dan
laju pertumbuhan N. oculata yaitu
7.483 x 104 sel/ml dengan
laju pertumbuhan maksimal sebesar 0,574 doubling/ hari. Namun tidak optimal untuk
meningkatan produksi total lipid N. oculata. Sementara aerasi selama 4 menit lebih optimal untuk
meningkatkan total lipid N. oculata.
Ucapan Terimakasih
Penulis
menyampaikan terimakasih kepada Ir. Ervia Yudiati, M.Sc. dan Ir.
Widianingsih, M.Sc.
sebagai dosen pembimbing yang telah memberikan pengarahan dan petunjuk dalam
menyelesaikan jurnal ilmiah ini.
Daftar
Pustaka
Ahmad,
A.L., Yasin, N.H.M., Derek, C.J.C., Lim, J.K., 2011. Microalgae as a
sustainable 754 energy source for biodiesel production: a review. Renewable and
Sustainable 755 Energy Reviews 15, 584–593. 756
Andersen,
S. 1995. Microencapsulated marine omega-3 fatty acids for use in the food
industry. Food Tech Euro 1: 104 - 105
[APHA]
American Public Health Association, American Water Works Association and Water
Pollution Control Federation. 1975. Standard Metode for the Examination of
water and wastewater. 14 th ed, APHA, Washington, DC 20036.1193 pp.
Bellou,
S. and G. Aggelis. 2013. Biochemical activities in Chlorella sp. and Nannochloropsis
salina during lipid and sugar synthesis in a lab-scale open pond simulating
reactor. J. Biotechnol.1:1-12
Bligh, E.G. and W.J. Dryer. 1959. A rapid method of
total lipid extraction and purification. Can.J.Biochem.Pysiol., 37:911-917
Boyd,
CE. 1982. Water Quality Management for
Pond Fish Culture. Elselvier Sci. Pub.Co., Amsterdam
Chang T,
Ohta S, Ikegami N, Miyata H, Kashimoto T, Kondo M. 1993. Antibiotic substances
produced by a marine green alga, Dunaliella primolecta. Bioresource Technology. 44: 149-153.
Chang,
E.H., Yang, S.S., 2003. Some characteristics of microalgae isolated in Taiwan
for biofixation of carbon dioxide. Bot. Bul. Acad. Sin. 44, 43–52.
Chisti,Y.
2007. Biodisel from Microalgae. Institute of Techonolgy and Engineering, Massey
University. Biotechnology Advances 25 (2007) 294–306.
Chiu,
S.Y, Kao, C.Y. Tsai, M.T. Ong, S.C, Chen C.H, and Lin, C.S. 2009. Lipid
Accumulation and CO2 Utilization of Nannochloroposis oculata to CO2
Aeration. Biosource Technology 100:833-838
de
Morais, M.G., Costa, J.A.V., 2007a. Biofixation of carbon dioxide by Spirulina
sp and Scenedesmus obliquus cultivated in a three-stage serial tubular
photobioreactor. J. Biotechnol. 129, 439–445.
de
Morais, M.G., Costa, J.A.V., 2007b. Isolation and selection of microalgae from
coal fired thermoelectric power plant for biofixation of carbon dioxide. Energy
Conv. Manag. 48, 2169–2173.
Guzman,
H.M., A de la Jara Valido, L.C. Duarte & K. F, Presmanes. 2010. Estimate by
means of flow cytometry of variation in composition of fatty acids from Tetraselmis
suecica in response to culture conditions. Aquacult, Int., 18: 189–199.
Hu H and
Gao K. 2006. Response of Growth and Fatty Acid Compositions of Nannochloropsis
sp. to Environmental Factors Under Elevated CO2 Concentration, Biotechnol Lett. 28: 987-992.
Ikhsan,
D., Yulianto, M.E., dan Ariwibowo, D.. 2006.,Studi
Awal Pembuatan Biodisel Secara Kontinyu dalam Bioreaktor Packed Coloumn dari Minyak Jarak
Pagar, Laporan Penelitian UNDIP.
Khoo HH,
Sharratt PN, Das P, Balasubramanian RK, Naraharisetti PK, Shaik S. 2011. Life
cycle energy and CO2 analysis of microalgae to biodisel: Preliminary
results and comparisons. Bioresource
Tech. 102:5800- 5807.
Mata,
T.M.. A.A Martins dan N.S Caetona. 2010. Microalgae for Biodisel
Production and Other Applications : A Review. Renewable and Sustainable
Energy Reviews. 14: 217-232
Olaizola,
M, T. Bridges, S. Flores, L. Griswold, J. Morency dan T. Nakamura. 2004.
Microalgal Removal of CO2 from Flue Gases : CO2 Capture
from a Coal Combuster, Biotech.
Bioproc. Eng. 8: 360-367
Panggabean,
L.M.G.2011. Fiksasi Karbondioksida pada
Mikroalga Chlorella sp., strain Ancol dan Nannochloropsis oculata.. Oseanologi dan Limnologi di Indonesia
37(2): 309-321
Pratoomyot,
J., P. Srivilas and T. Noiraksar. 2005. Fatty Acids Composition of 10 Microalgal
Species. Songklanakarin J. Sci.
Technol., 27(6): 1179- 1187.
Richmond,
A. 2003. Handbook of Microalgal
Culture Biotechnology and Applied Phycology. Blackwell Publishing.
Schenk,
P.M, R. Skye., Hall R.T., Stephens E., Max U.C.,. Mussgnug J.H, Posten C.,
Kruse O, and Hankamer B. 2008. Second Generation Biofuel: High Efficiency
Microalgae for Biodiesel Production. Bioenergi 1: 20- 43
Silva,
H.J., Pirt, S.J., 1984. Carbon dioxide inhibition of photosynthetic growth of
Chlorella. J. Gen. Microbiol. 130, 2833–283
Sung,
K.D., Lee, J.S., Shin, C.S., Park, S.C., Choi, M.J., 1999. CO2
fixation by Chlorella sp. KR-1 and its cultural characteristics. Bioresour.
Technol. 68: 269–273
Widianingsih, R. Hartati, H. Endrawati, E. Yudiati,
V.R. Iriani. 2011. Pengaruh Pengurangan
Konsentrasi Nutrien Fosfat dan Nitrat Terhadap Kandungan Lipid Total Nannochloropsis
oculata. Ilmu Kelautan 16 (1) 24-29
Wood, A.M., R.C. Everroad
and L.M. Wingard. 2005. Measuring Growth Rate in Microalgal Culture. Academic
Press: 269-283







0 comment:
Posting Komentar